CE标志被英国拒绝?北爱尔兰说NO
近日,MHRA发布了英国脱离欧盟后的医疗器械监管指南。自2021年1月1日起,目前通过欧盟体系进行的英国医疗设备市场监管将由MHRA(英国药品和保健品监管局)负责。虽然指南提出了新的UKCA标志的合格评定模式,但是北爱尔兰依然接受CE标志。
北爱尔兰地区的不同之处
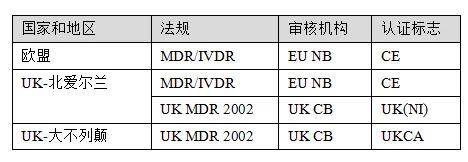
如大家所知,英国的全称是大不列颠及北爱尔兰联合王国。本次脱欧之后的医疗器械监管的模式上,虽然都属于联合王国,但是大不列颠和北爱尔兰存在一定的差异。
1.1北爱尔兰地区的不同之处
北爱尔兰具有特殊地位,欧盟规则将继续适用,尽管它不再是欧盟市场的一部分。这基本上意味着:
1、产品进入北爱尔兰市场,需要获得CE标志,同时需 要指定一个授权代表。
2、CE标志认证必须由欧盟认证机构完成。
3、UKCA认证不适用。
4、如果设备已由英国认可的机构进行评估,则UK(NI)标志,但不会取代CE标志。
5、同时带有CE标志和英国(NI)标志的产品不能投放欧盟市场。
6、除非附有CE标志或英国(NI)标志,否则北爱尔兰市场上不接受UKCA标志的设备。
1.2 北爱尔兰地区对授权代表和注册的不同要求
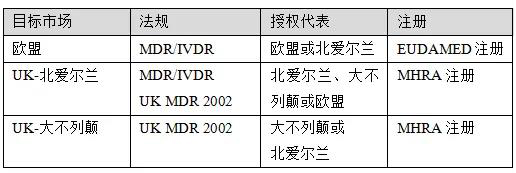
如果设备要进入北爱尔兰市场,经济运营商和设备的注册取决于其地理位置,具体如下:
1、如果制造商位于北爱尔兰,则公司必须向MHRA注册企业和所有设备;
2、如果制造商位于英国,但不在北爱尔兰,则公司必须在MHRA登记企业和设备,并指定一名授权代表。如果授权代表位于北爱尔兰,则该代表必须向MHRA登记。如果授权代表位于另一成员国,则该代表必须在该国注册。
3、如果制造商位于欧盟或欧洲经济区,公司必须指定一名英国负责人,该负责人必须位于英国,包括北爱尔兰。
4、如果制造商的总部位于英国、北爱尔兰、欧盟或欧洲经济区以外,则必须指定一名英国负责人,除非他们指定了一名驻北爱尔兰的授权代表。如果授权代表在MHRA注册了自己和设备,这些设备就可以进入英国市场。
医疗器械进入英国市场关键要求问答
1、现在持有CE证书的制造商可以继续将产品销往英国吗?有截止日期吗?
在2023年6月30日前,CE标识可继续使用及认可;在2023年6月30日前,由欧洲经济区(EEA)的公告机构签发的证书在英国市场继续有效。
2、除了获得CE认证之外,还有别的进入英国市场的途径吗?
自2021年1月1日起,预期将医疗器械设备投放至英国市场的制造商,将有一个新的市场和产品标记途径。这个新的途径就是取得UKCA认证。
3、在2023年6月30日之前和之后,进入英国市场的路径有什么差别?
在2023年6月30日之前,制造商可以有两个选择,CE或者UKCA;在2023年6月30日之后,只有一个选择,UKCA。
4、哪些机构可以开展UKCA认证?
位于英国的机构,如果原来是MDD/IVDD的公告机构,可以直接具备开展UKCA认证的资格。例如原来的BSI(NB0086),SGS(NB0120)等。
5、医疗器械进行UKCA认证的法规依据是什么?
《UK MDR 2002》,该英国法规文件是基于原医疗器械指令,体外诊断医疗器械指令和有源植入医疗器械指令转换而来的法规。值得说明的是,后续该法规依据会由MHRA进行更新。
6、欧盟医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)适用于英国吗?
MDR和IVDR将分别于2021年5月26日和2022年5月26日在欧盟成员国全面实施。由于这些规定在与欧盟的过渡时期结束后才会生效,因此它们不会被欧盟脱欧协议法案自动保留,不会自动适用于英国。
7、器械注册的规定有变化吗
有变化。原来只有一类医疗器械、体外诊断的Other类别器械以及定制式器械才需要进行注册。但是自2021年1月1日起,所有进入英国市场的医疗器械和体外诊断医疗器械(IVDs)都需要在MHRA注册。英国的注册将使用今年新投入使用的APPIAN系统,而不会使用欧盟的EUDAMED数据库系统。
8、器械注册要求的生效日期是什么时候?
从2021年1月1日开始生效,但根据产品的不同分类,其注册也有不同的宽限期:
1、IIb及III类植入式及所有现役植入式器械,宽限期4个月;
2、其它IIb及所有IIa类器械8个月;
3、所有I类器械12个月。
9、欧盟授权代表的要求有变化吗?
有变化,表现在:
1) 名称从欧盟授权代表变更为英国授权负责人;
2) 必须位于英国境内的机构,位于其余欧盟成员国不被认可;
3) 英国代表人的职责和权限与MDD下要求的欧盟授权代表类似
10、I类医疗器械还可以通过自我声明的模式进入英国市场吗?
医疗器械在贴上UKCA标识并投放英国市场之前,I类的医疗器械和普通体外诊断器械(IVDs)的制造商,可依据英国 《UK MDR 2002》(以2021年1月1日实施形式)第II部分和第IV部分的要求,进行自我符合性声明;而无菌或具有测量功能的I类器械,仍需获得认可机构的批准,才可贴上UKCA标识进入英国市场。
更多欧盟医疗器械ce认证、美国510k注册咨询,关注【feiying-china.com】

